Ein nachlassen der Aktivität unserer Zellkraftwerke wird hinter dem Phänomen des Alterns im Allgemeinen und auch hinter den im Alter vermehrt auftretenden Erkrankungen, wie Diabetes, Herz-Kreislauf- Erkrankungen und Krebs vermutet. (1)
Dabei sind drei Veränderungen, welche das Altern auf zellulärer Ebene erkennen lassen, besonderes mit den Mitochondrien verknüpft:
- die Entstehung von sogenannten „seneszenten Zellen“ ,
- das Auftreten chronischer Entzündungen und
- der Rückgang an Stammzellen.
Professor Finkel: „Zusammen betrachtet zeigt sich ein Einfluss der Mitochondrien auf eine Reihe von Schlüsselfaktoren des Alterns und weist darauf hin, dass Strategien welche die Funktion der Mitochondrien verbessern, weitreichende Effekte von großem Vorteil haben werden. Eine neue Ära, von auf Mitochondrien ausgerichteten Therapien, wird es ermöglichen den Alterungsprozess zu verlangsamen oder umzukehren.“
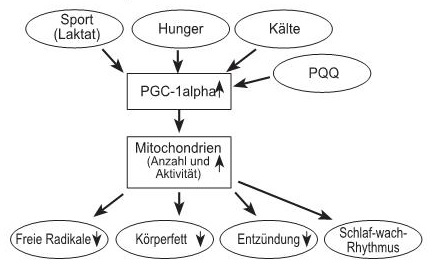
Auch der Forscher Tomas Prolla kommt zu dem Schluss, dass eine verbesserte Mitochondrienfunktion den Alterungsprozess verlangsamt und so auch das Auftreten der mit diesem Prozess einhergehenden Krankheiten verzögert. Er betont die Wichtigkeit des in den Zellen gebildeten „Stoffwechselhormons PGC1alpha als Schlüssel für eine optimale Mitochondrienfunktion: „Der Transkriptions-Co-Aktivator PGC-1α ist ein kritischer Regulator des mitochondrialen Energiestoffwechsels und der Biogenese (Neubildung von Mitochondrien). Damit ist PGC-1α einzigartig als potentielles Ziel für die Korrektur der Auswirkungen des Alters.“(2) (siehe auch PDF Laktat)
Auch Johan Auwerx sieht PGC-1α als wichtigsten Regler einer ganzen Kaskade von Stoffwechselprozessen. „Der Peroxisomproliferator-aktivierte Rezeptor-γ-Coaktivator 1 & alpha (PGC-1α) hat sich als Hauptregulator der mitochondrialen Biogenese und Funktion herausgebildet und ist somit ein entscheidender metabolischer Knotenpunkt geworden.“
Auwerx fasst zusammen wie Kälte, Fasten und körperliche Erschöpfung die Freisetzung des Stoffwechsel- Hormons PGC-1α fördern und wie ein erhöhter Insulinspiegel dieses Verjüngungshormon blockiert. (3)
(1) Toren Finkel: The Mitochondrial Basis of Aging https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4779179/
(2) Tomas Prolla: PGC-1alpha in aging and anti- aging interventions
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2743759/
(3) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3057551/
Übergewicht ist ein zunehmendes Problem! Aber Spaß beiseite: der Leidensdruck ist enorm und die gesundheitlichen Folgen sind gravierend. Hinzu kommt, dass immer mehr Kinder heute übergewichtig sind. Schuld ist anscheinend vor allem der in Speisen und Getränken versteckte Zucker.
Nun zeigen Studien (1), dass die Mitochondrien schon bei diesen Kindern eine verringerte Aktivität zeigen. Neben einer zwingend notwendigen Reduktion der Zuckeraufnahme, sind also auch bei übergewichtigen Kindern gezielte Maßnahmen sinnvoll, welche die Mitochondrienzahl und Aktivität erhöhen.
Wie Sie in meinem Artikel „PQQ: Gesund älter werden dank "Sternenstaub"“ lesen können, führen Überernährung und Bewegungsmangel nicht nur zu Übergewicht, sondern auch zu einer vermehrten Produktion von freien Radikalen (ROS). Diese schädigen unsere Mitochondrien und führen so zu einer schlechteren Zuckerverwertung. Der Teufelskreis schließt sich.
In einer Studie von 2010 (2) schreiben die Autoren: „Nährstoffüberschuss führt zu Fehlfunktionen der Mitochondrien, was wiederum zu Fettleibigkeit bedingten Krankheiten führt, teilweise aufgrund der schädlichen Auswirkungen von ROS. Die kürzliche Erkenntnis von "ektopischem" braunem Fettgewebe bei Menschen legt nahe, dass dieses Gewebe eine unterschätzte Rolle bei der Kontrolle des Energieverbrauchs spielen könnte. Transkriptionsfaktoren, PGC-1α und PRDM16, die die braune Adipogenese regulieren, und Mitglieder der TGF-β-Superfamilie, die diesen Prozess modulieren, können wichtige neue Ziele für Arzneimittel gegen Fettleibigkeit sein.“
Das uns bekannte Zellhormon PGC1alpha wird also auch als medikamentöses Ziel einer Behandlung von Fettleibigkeit erklärt. PGC1alpha führt laut dieser Studie zu einer vermehrten Bildung von „braunem Fett“. Dieses braune Fettgewebe „frisst“ unser überschüssiges Körperfett auf und beugt Krankheitsentwicklungen vor. Wie wir wissen gibt es auch noch andere „Tricks“, das PGC1alpha vermehrt auszuschütten: Sport (Laktat), Kältereize und das Fasten (siehe Graphik).
Und dass das PQQ die Ausschüttung von PGC1 alpha anregt wird in letzter Zeit immer wieder bestätigt (3).
Unsere Vorfahren erlebten regelmäßig harte Zeiten, in denen Nahrung knapp war und z.B. unter widrigen Umständen lange Märsche unternommen werden mussten. In diesen Zeiten bereitete der Körper sich darauf vor, optimale Bedingungen für eine mögliche Fortpflanzung in besseren Zeiten zu schaffen. Die Zellen entgifteten und verjüngten sich. Diese Anstrengungen und Entbehrungen lösten einen Funktionsmodus der Mitochondrien aus, den ich als “Winter”-Modus bezeichne. Zeiten von großzügigem Nahrungsangebot und guten Lebensbedingungen lösten einen anderen Funktionszustand der Mitochondrien aus, den ich als “Sommer”-Modus bezeichne. Das regelmäßige Umschalten zwischen diesen beiden Funktions- Modi ist immer noch der Garant für eine optimale Gesundheit.
| Sommer / Tag | Winter / Nacht |
Kalorienzufuhr | hoch | niedrig |
Glykolyse | hoch | niedrig |
Sauerstoffbasierte Energieproduktion (oxidative Phosphorylierung)
| niedrig | hoch |
Entzündungsbereitschaft | hoch | niedrig |
Stoffwechselfunktion | Wachstum | Regeneration |
Hauptregulatoren
| vorwiegend entzündungsfördernde Zellbotenstoffe (mTOR, NADPH, ATP, PI3K, AKT, TGFß) | vorwiegend verjüngungsfördernde Zellbotenstoffe (AMPK, NAD+, AMP, PGC1a, FOXO, PKA) |
Sirtuine (Hausmeister-Enzyme: beugen Alzheimer, Krebs, Diabetes vor) | niedrig | hoch |
weißes Fettgewebe | hoch | niedrig |
braunes Fettgewebe | niedrig | hoch |
Abbau und Wiederverwendung geschädigter Zellen (Autophagie) | niedrig | hoch |
Mitochondrien überwiegend | Anhäufung von Gewebebausteinen (Cataplerose) | ATP-Erzeugung, Wartungsarbeiten (Anaplerose) |
Nahrungsverwertung überwiegend | Stoffwechselbausteine, Fette, Eiweiße | ATP, CO2, Wärme |
Sauerstoffverbrauch | niedrig | hoch |
Schwache Mitochondrien | vermehren sich | werden ausrangiert |
Freie Radikale | hoch | niedrig |
Fettverbrennung | niedrig | hoch |
Abhängig davon, ob sich die Mitochondrien im Sommer- oder Winter-Modus befinden, funktionieren sie unterschiedlich. Im Sommer-Modus produzieren sie keine Energie, sondern stecken ihre Leistung in die Neubildung von Zellbausteinen und in die Abwehr. Um vom Sommer- in den Wintermodus umzuschalten benötigen die Mitochondrien ein deutliches, anhaltendes Signal. Solche Botenstoffe – auf Zellebene sind es das Laktat und die Ketonkörper – können durch schwere körperliche Arbeit und Fasten ausgelöst werden. Der Wintermodus führt zu einer maximalen Energieausbeute, wobei das eingelagerte Körperfett als saubere Energiequelle dient. Zudem führt der Körper im “Winter”- Modus „Wartungsarbeiten“ in den Zellen durch. Heutzutage befindet sich unser Körper durch das ständige Nahrungsüberangebot und unsere bequeme, bewegungsarme Lebensweise oft in einem ständigen Sommer-Modus. Gewebsentzündungen, Autoimmunerkrankungen, Arterienverkalkung, Herzinfarkt oder Schlaganfall können die Folge sein.